Bioimpresión 3D logra imitar la estructura del tejido muscular del corazón.
Autora

Laboratorio de Ingeniería de Tejidos y Biología Sintética
Departamento de Bioingeniería
lperez@utec.edu.pe
El miocardio es un tejido muy anisotrópico, con miocitos (eje largo aproximadamente 10 veces el eje transversal) organizados en haces paralelos. La organización de las miofibras es importante para la función cardíaca y la conducción del impulso eléctrico [1], siendo todo un reto para la ingeniería de tejidos los efectos de la alineación de los cardiomiocitos sobre el acoplamiento en la excitación-contracción, el acortamiento y el desarrollo de la fuerza. En una distribución 3D es posible controlar la forma celular y la orientaciones mediante la ingeniería de microestructuras de andamios y encapsulando células, en un reciente paper [2], muestran un método novedoso de encapsulación celular en andamios 3D de gelatina metacrilada (GelMA) modelados a través de impresión óptica continua a microescala (μCOP) la cual puede crear un micropatrón rápido de cardiomiocitos ventriculares de ratón neonatal (NMVCM) en hidrogeles fotorreticulables. Los cardiomiocitos encapsulados se alinean preferentemente con la microarquitectura diseñada y pueden mostrar la morfología y la alineación fenotípica de las miofibrillas del miocardio in vivo.
Pero ¿Qué es el sistema μCOP y cómo crearon el micropatrón de cardiomiocitos? Este sistema proyecta una imagen 2D en un volumen de solución de prepolímero, emparejando el movimiento de la etapa con cambios en las máscaras digitales, proporcionando una mayor resolución z, logrando imprimir estructuras 3D complejas en segundos a alta resolución (~ 1 μm) en múltiples órdenes de magnitud en escala [3]. Los patrones definidos por el usuario se cargan en el chip del dispositivo digital de microespejos (DMD), designando los espejos como «encendidos» o «apagados». Los espejos que están «encendidos» reflejan la luz ultravioleta, que posteriormente se enfoca mediante la óptica de proyección sobre la solución de prepolímero, iniciando inmediatamente la polimerización para producir una estructura 3D que replica el patrón designado, usando las biotintas apropiadas, las células pueden modelarse directamente en un hidrogel 3D, lo que permite el control sobre la alineación y concentración de células en la construcción de tejido impreso. [2]
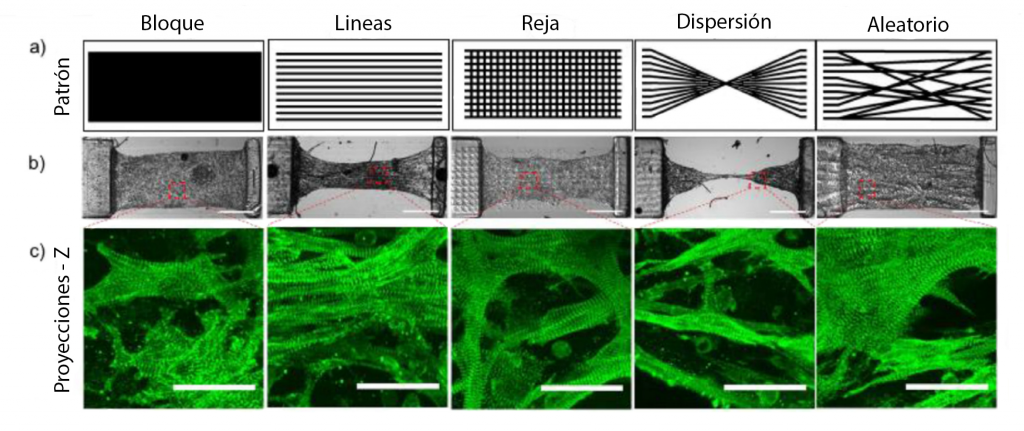
Fuente: J. Liu, et al. Biomaterials (2020).2
Utilizando µCOP, los autores diseñaron un sistema de medición de fuerza asimétrico y personalizable con patrón directo de cardiomiocitos encapsulados. Los cardiomiocitos ventriculares de ratón neonatal (NMVCM) se alinearon progresivamente con la microarquitectura diseñada y formaron un tejido que se contraía sincrónicamente con una fuerza determinada mediante la desviación de un medidor de fuerza integrado impreso en 3D. Encontrando que la impresión 3D directa de células en un patrón anisotrópico mejora la alineación del sarcómero y la producción de fuerza del tejido cardíaco, en comparación con las muestras sembradas en geometría coincidente.
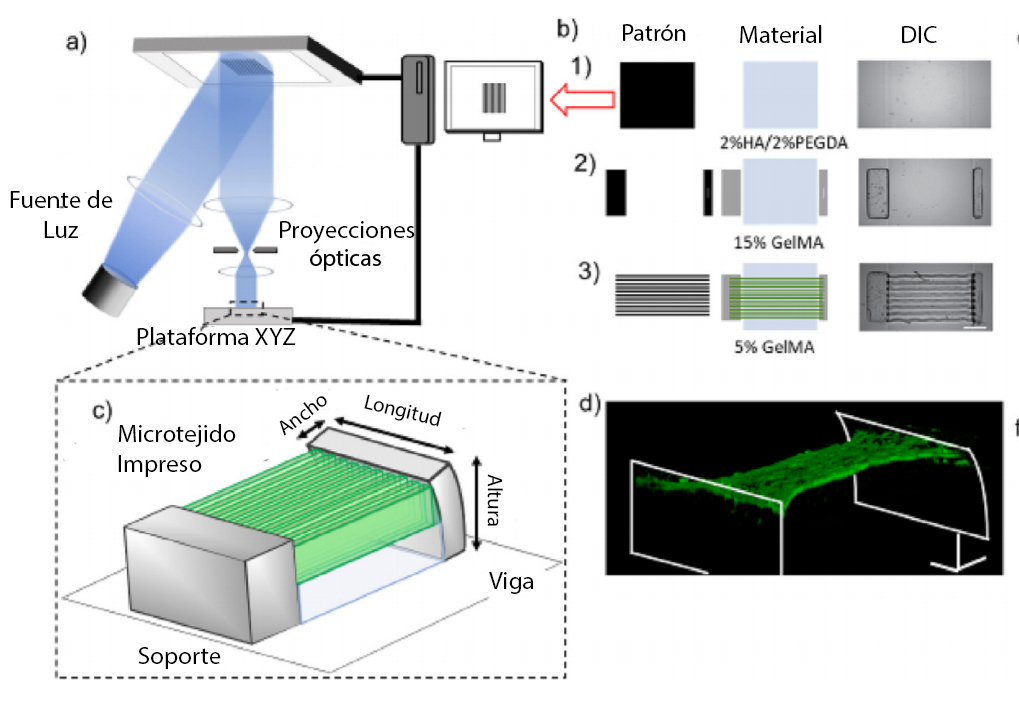
Fuente: J. Liu, et al. Biomaterials (2020).2
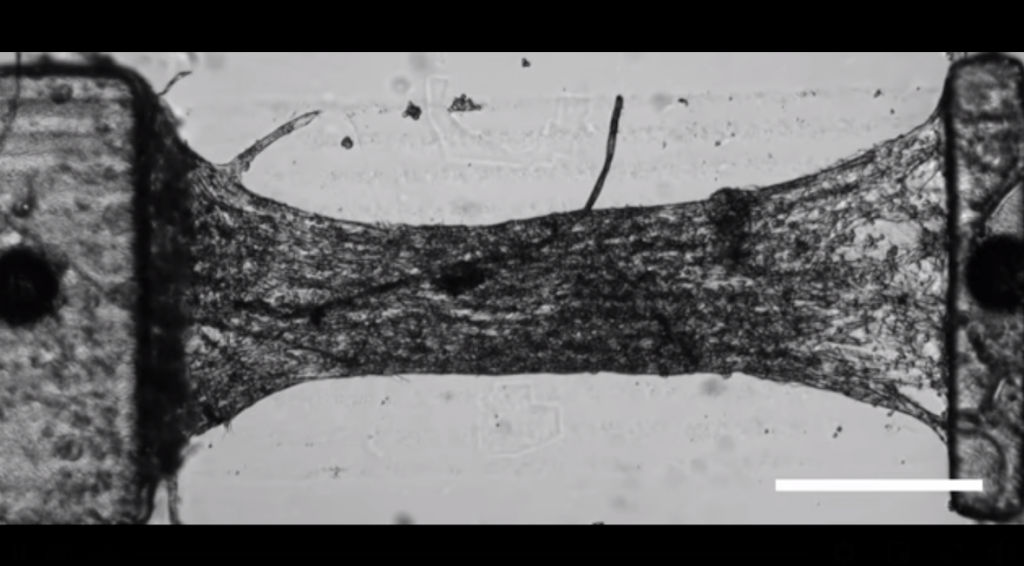
Fuente: Biomaterials (2020).
* DIC:Correlación Digital de Imágenes
Bibliografía
1. Campanale CM, Scherrer B, Afacan O, Majeed A, Warfield SK, Sanders SP. Myofiber organization in the failing systemic right ventricle. Journal of Cardiovascular Magnetic Resonance. 2020. doi:10.1186/s12968-020-00637-9
2. Liu J, Miller K, Ma X, Dewan S, Lawrence N, Whang G, et al. Direct 3D bioprinting of cardiac micro-tissues mimicking native myocardium. Biomaterials. 2020. p. 120204. doi:10.1016/j.biomaterials.2020.120204
3. Wei Zhu, Jinxing Li, Yew J. Leong, et al. 3D Printed Artificial Micro- Fish Adv Mater. 2015 Aug; 27(30): 4411–4417. doi: 10.1002/adma.201501372
4. Video disponible en: https://twitter.com/Biomaterials_/status/1313503646487908353?s=20
https://www.facebook.com/watch/?v=335713944373242