Autora: Luz Pérez- Laboratorio de Ingeniería de Tejidos y Biología Sintética. Departamento de Bioingeniería
El cáncer es una patología multifacética, en la cual un tejido crece sin control debido a la expresión y comportamiento alterados de las señales proliferativas y de supervivencia, en el cual los elementos celulares y acelulares interactúan para impulsar la progresión y, en el peor de los casos, la metástasis. Los métodos actuales (cultivos celulares en monocapa o 2D y modelos animales) para investigar la naturaleza heterogénea del cáncer son inadecuados. Los cultivos celulares en monocapa reflejan insuficientemente el patrón de respuesta fisiológica de la situación in vivo debido a diferencias geométricas fundamentales entre cultivos bidimensionales (2D) y tumores sólidos tridimensionales (3D). Es necesario generar una arquitectura 3D de células tumorales in vitro para simular el microambiente multicelular al investigar la fisiología de las células tumorales y la respuesta a los agentes terapéuticos.
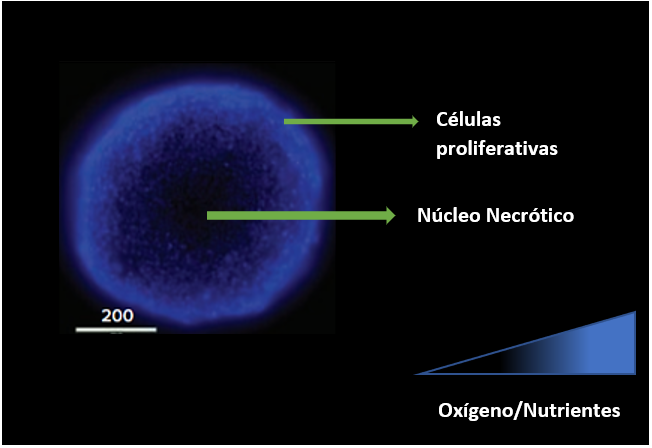
Los esferoides se forman cuando se permite que las células crezcan en suspensión, como resultado de lo cual se agregan, ya sea por sí mismas o con la ayuda de matrices extracelulares. La formación de los esferoides es posible gracias a las proteínas de membrana (integrinas) y las proteínas de la matriz extracelular. En la formación del esferoide se dan estos pasos: (i) las células dispersas se agregan debido a fibras de ECM que contienen motivos RGD que permiten unir la integrina de la superficie celular y esto conduce a la expresión de cadherinas, (ii) las cadherinas se acumula en la superficie de membrana celular, (iii) la unión cadherina-cadherina entre las células vecinas permite estrechar las conexiones entre las células y se forman los esferoides; los cuales son considerados un modelo in vitro mejorado para imitar las propiedades biológicas de las micrometástasis y las regiones distales de los vasos de los tumores porque retienen la arquitectura y muchas características morfológicas y fisiológicas de sus homólogos tumorales. Se viene utilizando ampliamente como modelo 3D a los esferoides tumorales multicelulares para estudiar la proliferación, apoptosis, diferenciación, expresión génica y metabolismo de células tumorales en un contexto multicelular ya que las células tumorales en esferoides muestran un mayor grado de diferenciación morfológica y funcional que las células cultivadas en cultivo monocapa. Mostrando también cinética de crecimiento, tasas metabólicas y resistencia a la radioterapia y quimioterapia similar a las células tumorales in vivo. El aumento de los contactos célula-célula y célula-matriz en los esferoides compactos no solo alteran los patrones de expresión génica y resistencia al tratamiento antineoplásico, también limitan la difusión de nutrientes, oxígeno y productos de desecho dentro y fuera de los esferoides dando lugar a una composición más estratificada, con el borde de los esferoides que consta de células en proliferación, seguido de un capa de células quiescentes en el medio y un interior inactivo con células necróticas en el núcleo de la esfera.
La calidad de los esferoides también se puede evaluar mediante técnicas de marcaje celular. Por ejemplo, los agregados celulares se teñirán de manera homogénea con un tinte específico como tinción tricrómica de Masson (color rojo es asociado con la deposición de colágeno), Hematoxilina eosina (azul, núcleos celulares; rosado algunas proteínas de matriz), azul de toluidina (tiñe ADN) a o mediante diferentes marcadores como caspasa 3 (apoptosis), EF5, factor inducible por hipoxia (hipoxia), Ki 67 (proliferación celular). También en el mercado existen tinciones fluorescentes como los kit live/dead cells, para poder evaluar el número de células vivas y muertas del esferoide.
Referencias Bibliográficas:
Białkowska, K., Komorowski, P., Bryszewska, M., & Miłowska, K. (2020). Spheroids as a type of three-dimensional cell cultures—examples of methods of preparation and the most important application. International Journal of Molecular Sciences, 21(17), 1–17. https://doi.org/10.3390/ijms21176225
Bianchi, M. E., & Mezzapelle, R. (2020). The Chemokine Receptor CXCR4 in Cell Proliferation and Tissue Regeneration. Frontiers in Immunology, 11(August), 1–8. https://doi.org/10.3389/fimmu.2020.02109
Costa, E. C., Moreira, A. F., de Melo-Diogo, D., Gaspar, V. M., Carvalho, M. P., & Correia, I. J. (2016). 3D tumor spheroids: an overview on the tools and techniques used for their analysis. Biotechnology Advances, 34(8), 1427–1441. https://doi.org/10.1016/j.biotechadv.2016.11.002
Ivascu, A., & Kubbies, M. (2006). Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. Journal of Biomolecular Screening, 11(8), 922–932. https://doi.org/10.1177/1087057106292763
Molecular Devices Application Note: High-Throughput Confocal Imaging of Spheroids for Screening Cancer Therapeutics https://www.moleculardevices.com/en/assets/app-note/dd/img/high-throughput-confocal-imaging-of-spheroids-for-screening-cancer-therapeutics#gref